L’oxygénothérapie
Santé Canada et la Loi sur les aliments et drogues
Conformément à la Loi sur les aliments et drogues:
Sont compris parmi les drogues les substances ou mélanges de substances fabriqués, vendus ou présentés comme pouvant servir :
Le saviez-vous?
Santé Canada administre la Loi sur les aliments et drogues.
Lorsqu’une drogue est autorisée, Santé Canada délivre un numéro d’identification de drogue de huit chiffres permettant au fabricant de
commercialiser cette drogue au Canada.
Santé Canada établit les normes et les lignes directrices liées à la fabrication de drogues et produits de santé (dont les gaz médicaux comme l’oxygène), afin de veiller à leur sécurité aux fins d’utilisation chez les êtres humains et les animaux.
Au Canada, les contenants et appareils d’oxygène thérapeutique nécessitent un étiquetage approprié comprenant des numéros d’identification de drogue
Aperçu des phases d’action des médicaments
(adapté de Rau J.L., 2002, p. 13)
Administration du médicament
Phase pharmacocinétique
Phase pharmacodynamique
Effet
Indications de l’oxygénothérapie
Hypoxémie documentée, définie comme la diminution du PaO2 dans le sang, à taux inférieur au taux normal. PaO2 de < 60 torr ou un SaO2 de < 90 % chez les patients qui respirent l’air ambiant ou PaO2 et (ou) SaO2inférieur au taux désiré pour certaines situations cliniques précises. Les taux cliniques acceptables dépendent de l’âge, de l’état et de la maladie du patient.
Absorption de pneumothorax.
Le saviez-vous?
L’approche fondée sur les preuves de traitement de MPOC avec l’oxygène est en constante évolution. L’American Thoracic Society a publié de nouvelles lignes directrices à ce sujet en 2020 :
New COPD Oxygen Therapy Guidelines
« L’oxygène est utilisé pour traiter l’hypoxémie, et non l’essoufflement. Il n’a jamais été démontré que l’oxygène puisse avoir quelque effet que ce soit sur la sensation d’essoufflement chez les patients non hypoxémiques. » BTS 2017
Contrindications absolues et effets possiblement négatifs
Contrindications absolues
Effets possiblement négatifs
Objectifs de l’oxygénothérapie
“L’oxygénothérapie est habituellement définie comme l’administration d’oxygène à des concentrations supérieures aux concentrations que l’on retrouve dans l’air
ambiant » (BTS, 2011. p. vi27).
Le principal objectif de l’oxygénothérapie est de :
« Traiter ou prévenir l’hypoxémie, empêchant ainsi l’hypoxie des tissus qui peut causer des lésions aux tissus, voire la mort cellulaire » (BTS, 2011. p. vi27).
Hypoxie
Le saviez-vous?
L’hypoxie peut exister même si l’hypoxémie a été supprimée grâce à l’oxygénothérapie.
Exemples :
• Au niveau cellulaire si les cellules ne sont pas en mesure d’accéder ou d’utiliser l’O2transporté
• Au niveau des tissus si l’O2 ne peut atteindre les cellules en raison d’un blocage d’artère
Voici les causes de l’hypoxie (BTS, 2011, p. vi14) :
• Hypoxémie (p. ex., à haute altitude)
• Hypoxémie anémique (p. ex., réduction d’hématocrite ou empoisonnement par le monoxyde de carbone)
• Hypoxémie stagnante (p. ex., choc, ischémie)
• Hypoxie/dysoxie histotoxique (p. ex., empoisonnement par le cyanure).
L’hypoxémie
Si la pression partielle d’O2 (PaO2) est inférieure au niveau prévu en fonction de l’âge de la personne, il y a hypoxémie.
Voici certaines causes d’hypoxémie :
Hypoventilation, non concordance V/Q (p. ex., MPOC).
Shunt anatomique (p. ex., anomalies cardiaques).
Shunt physiologique (p. ex., atélectasie).
Déficit de diffusion (p. ex., maladie pulmonaire interstitielle).
Déficience d’hémoglobine
Le saviez-vous?
• L’état de chaque candidat doit être stabilisé et le traitement doit être optimisé avant d’envisager l’oxygénothérapie à long terme. L’abandon du tabagisme est nécessaire pour optimiser le traitement.
• Les candidats doivent être atteints d’hypoxémie chronique au repos à l’air ambiant (Pa02 de 55 mmHg ou moins ou Sa02 de 88 % ou moins).
• Les candidats présentant un Pa02 persistant de 56 à 60 mmHg pourraient être de bons candidats à l’oxygénothérapie à long terme si une des conditions suivantes est présente :
• cœur pulmonaire;
• hypertension pulmonaire; ou
• erythrocytose persistante.
De plus, certains candidats présentant un Pa02persistant à 56 à 60 mmHg pourraient être de bons candidats à l’oxygénothérapie à long terme en présence de :
• hypoxémie limitée à l’exercice
• amélioration avec supplément d’oxygène consignée
• hypoxémie nocturne.
Tiré de : www.health.gov.on.ca/en
Les effets de l’hypoxie et de l’hypoxémie
(O’Driscoll, 2008)
Hypoxie
| Effets | Risques | |
|---|---|---|
| Système respiratoire | - Augmentation de la ventilation - Vasoconstriction pulmonaire | - Hypertension pulmonaire |
| Système cardiovasculaire | - Vasodilatation coronaire - Diminution de la résistance vasculaire générale (passagère) - Augmentation du débit cardiaque - Tachycardie | - Ischémie myocardique/infarctus du myocarde - Ischémie/infarctus d’autres organes irrigués de façon critique - Hypotension - Arrhythmie |
| Système métabolique | - Augmentation de 2,3-DPG - Augmentation du transport de CO2 (effet Haldane) | - Acidose lactique |
| Système neurologique | - Augmentation du débit cérébral en raison de la vasodilatation | - Confusion - Délire - Coma |
| Système rénal | - Activation de l’axe rénineangiotensine - Augmentation de la production d’érythropoïétine | - Nécrose tubulaire aigüe |
Hyperoxie
| Effets | Risques | |
|---|---|---|
| Système respiratoire | - Diminution de la ventilation | - Détérioration de la ventilation/concordance de perfusion - Atélectasie (absorption) |
| Système cardiovasculaire | - Ischémie du myocarde (contexte de diminution des hématocrites) - Réduction du débit cardiaque - Réduction du débit sanguin coronarien - Augmentation de la tension sanguine - Augmentation des dérivés réactifs de l’oxygène |
|
| Système métabolique | - Diminution de 2,3-DPG - Diminution du transport de CO2 (effet Haldane) | - Augmentation des dérivés réactifs de l’oxygène |
| Système neurologique | - Diminution du débit sanguin cérébral | |
| Système rénal | - Réduction du débit sanguin rénal |
L’instinct de respiration et la rétention de bioxyde de carbone
Le but premier de l’oxygénothérapie est de traiter l’hypoxémie. Toutefois, un nombre très restreint de patients atteint de la maladie pulmonaire obstructive chronique (MPOC) sont sensibles à des niveaux plus élevés d’O2.
La saturation cible chez les patients à risque d’insuffisance respiratoire (hypercapnie) est de 88 à
92 % (BTS, 2016) à moins de prescription contraire, en attente de résultats des gaz sanguins.
Si vous ne savez pas si un patient présente une sensibilité à l’O2, le principal objectif est de traiter l’hypoxémie.
Pour obtenir de plus amples renseignements sur les lignes directrices concernant les pratiques exemplaires afin de traiter la MPOC, voyez le site Web des lignes directrices pour le traitement de la MPOC de la Société canadienne de thoracologie.
EL’accent est toujours mis sur les façons d’éviter l’hypoxémie et l’hypercapnie qui sont nocives en dosant soigneusement l’O2 et en contrôlant les gaz sanguins artériels.
Le saviez-vous?
La portée normale de bioxyde de carbone admissible est habituellement de 35-45 mmHg.
Habituellement, une augmentation du CO2 fait augmenter la ventilation. Les patients atteints de certaines maladies respiratoires comme la MPOC
présentent parfois une sensibilité réduite à une augmentation du CO2.
L’entraînement hypoxique désigne la dépendance du patient à de faibles niveaux d’oxygène sanguin artériel (PaO2) pour stimuler la respiration, tel qu’on le dénote chez certains patients atteints de MPOC.
Si on donne trop d’O2à un patient qui dépend de l’entraînement hypoxique pour respirer, le niveau d’oxygène dans le sang augmente, mais le niveau de CO2 augmente aussi, entraînant l’acidose respiratoire et la défaillance
Comment l’oxygénothérapie fonctionne-t-elle?
physiologie du transport d’oxygène et de l’échange gazeux.
Transport d’oxygène
exerce une pression dans le système vasculaire que l’on peut mesurer au moyen d’un échantillon sanguin (p. ex., gazométrie du sang artériel). On parle alors de la pression partielle de l’oxygène dans le sang artériel, que l’on représente par le symbole: PaO2.
La plus grande partie de l’oxygène transporté dans le sang est transporté par l’hémoglobine. Une très petite quantité d’oxygène est transporté dissout dans le
plasma. Cet oxygène dissout peut être mesuré au moyen d’un échantillon de sang artériel. On parle alors du PaO2 qui est un moyen important d’évaluer l’hypoxie.
La courbe de dissociation de l’oxyhémoglobine
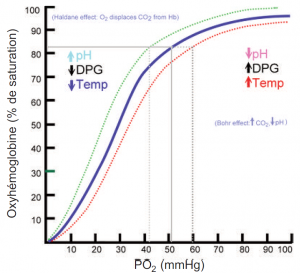
Cette courbe permet de comprendre comment le sang transporte et libère l’oxygène. Dans la courbe de dissociation de l’oxygène, on compare la saturation d’oxygène (SO2) à la pression partielle de l’oxygène dans le sang (PO2), On obtient une courbe démontrant la facilité avec laquelle l’hémoglobine acquiert et libère les molécules d’oxygène dans le liquide qui l’entoure (affinité oxygène-hémoglobine).
Voici certains facteurs qui ont une incidence sur le chargement et le déchargement de l’oxygène :
- pH sanguin (effet Bohr)
- Température du corps
- Concentration d’érythrocytes dans certains phosphates organiques (p. ex., 2,3 diphosphoglycérate)
- Variation de la structure des molécules d’hémoglobine (Hb) (p. ex., cellules falciformes, méthémoglobine (metHb) et hémoglobine fœtale (HbF))
- Combinaisons chimiques de Hb avec d’autres substances (p. ex.,monoxyde de carbone)
N’oublions pas que les modifications de ces facteurs peuvent entraîner un déplacement de la courbe de dissociation de l’oxygène vers la gauche ou la droite, ce qui aura un effet sur l’affinité oxygène-hémoglobine
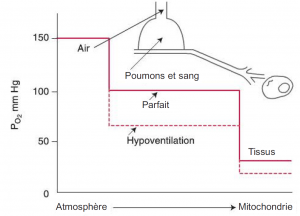
Échange gazeux (d’oxygène)
Cascade d’oxygène
Équation de l’air alvéolaire
PAO2 = [(PB-PH2O) * FiO2] – PaCO2 /RQ
Diffusion normale d’oxygène
Information concernant la diffusion d’oxygène dans des poumons normaux à température et pression corporelle – saturé (BTPS) :
La pression partielle de l’oxygène dans les alvéoles (PAO2) est d’environ 100 mmHg.
En théorie, la pression partielle du sang capillaire doit monter jusqu’à égaler la pression partielle de l’oxygène dans les alvéoles. Par conséquent, la pression partielle de l’oxygène dans le sang artériel (PaO2) doit être d’environ 100 mmHg, le PaO2chez les personnes en santé respirant de l’air au niveau de la mer est toujours d’environ 5 à 10 mmHg inférieur au PaO2. PaO2 calculé. Deux facteurs expliquent cette différence : 1) les shunts de droite à gauche dans la circulation pulmonaire et cardiaque et 2) les différences régionales dans la ventilation pulmonaire et le débit sanguin (Kacmarek, Stoller, Heuer, 2013, p. 255). Le PaO2 normal varie habituellement entre 90 et 95 mmHg; toutefois, dans les cliniques, la normoxémie chez les adultes et les enfants se situe à 80-100 mmHg.
Les patients néonataux ont un PaO2 inférieur à celui des adultes et des enfants. Chez ces patients, la normoxémie est à 50-80 mmHg en raison des shunts anatomiques à la naissance et de la nature de l’hémoglobine foetale.
Au niveau des tissus, l’oxygène se diffuse à partir du sang (Pcapillaries O2= 40 mmHg ) dans la microvasculature et l’espace intermédiaire dans la cellule (Pintracellular O2= 5mmHg) où se produit la respiration cellulaire.
La première loi de la diffusion de Fick décrit très bien le mouvement gazeux dans la membrane alvéolo-capillaire.
Loi de la diffusion de Fick
V = A x D (P1 – P2)
T
Les facteurs ayant un effet sur l’échange gazeux sont les suivants :
V = débit de gaz (oxygène)
A = zone transversale disponible à la diffusion
D = coefficient de diffusion
P1 – P2 = gradient de pression partielle
P1 = pression partielle d’oxygène dans l’alvéole (PAO2)
P2 = pression partielle d’oxygène dans le sang (PaO2)
T = épaisseur de la membrane (membrane alvéolo-capillaire)
Facteurs physiopathologiques affectant l’échange gazeux
Voici certains facteurs physiopathologiques influençant l’échange gazeux d’oxygène :
GLOSSAIRE
Appareils de conservation - La durée d’une bouteille de liquide dépend de la quantité d’oxygène que l’on utilise. Les appareils de conservation en prolongent la durée. Les appareils d’oxygène fournissent de l’oxygène de façon continue pendant l’inspiration et l’expiration. On peut programmer les appareils de conservation pour fournir de l’oxygène pendant l’inspiration seulement, réduisant ainsi le gaspillage pendant l’expiration.
Contenant cryogénique – Contenant statique ou mobile, isolé, conçu pour contenir du gaz liquéfié à des températures extrêmement basses. Les contenants mobiles sont aussi désignés par « Dewars ». Tiré de : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/conformite-application-loi/bonnes-pratiques-fabrication/documents-orientation/lignes-directrices-0031/document.html
Distillation fractionnée – Processus de séparation des parties d’un mélange en le chauffant et en condensant ses composantes selon leurs points d’ébullition différents. Tiré de : http://medical-dictionary.thefreedictionary.com/fractional+distillation.
Gaz thérapeutique – Un seul gaz ou un mélange de plusieurs gaz ne nécessitant aucun autre traitement avant d’être administré(s). Toutefois, ce ou ces gaz ne sont pas dans leur forme finale (p. ex., oxygène liquéfié) et sont désignés par gaz en vrac. Tiré de : http://ccinfoweb2.ccohs.ca/legislation/documents/stds/csa/cmgpi12e.htm
Numéro d’identification de drogue (DIN) – Numéro de huit chiffres généré par ordinateur qui est attribué par Santé Canada avant la commercialisation au Canada. Ce numéro est unique et sert à identifier tous les médicaments vendus dans une forme posologique. Il est inscrit sur l’étiquette d’un médicament de prescription ou d’un médicament sans ordonnance qui ont été évalués et approuvés pour la vente au Canada. Un DIN énumère les caractéristiques du produit : fabricant, nom du produit, ingrédient(s) actif(s), la force de l’ingrédient médicinal, la forme posologique et la voie d’administration. Tiré de : www.hc-sc.gc.ca/dhp-mps/prodpharma/activit/fs-fi/dinfs_fd-fra.php.
Système à tubulure – Équipement ou appareil conçu pour remplir un ou plusieurs contenants de gaz à la fois.
(TPA) Température et Pression Ambiante = température et pression standard = 0 °C, atmosphère 1
TPCS = Température et pression corporelle – saturé = 37 °C, atmosphère 1 et 44 mg H2O/L
ANNEXE
- American Thoracic Society (2020) Clinical Practice Guideline: Home Oxygen Therapy for Adults with Chronic Lung Disease. Tiré de : https://www.atsjournals.org/doi/pdf/10.1164/rccm.202009-3608ST
- Becker, D. E., & Casabianca, A. B. (2009). Respiratory monitoring: physiological and technical considerations. Anesthesia Progress, 56(1), 14-20. doi: 10.2344/0003-3006-56.1.14.
- Cairo, J., M. & Pilbeam, S., P., (2017) Mosby’s Respiratory Care Equipment (10th ed.). St. Louis, MO: Mosby.
- Canadian Standards Association. (2016). Z305.12-06 (R2012) - Safe Storage, Handling, and Use of Portable Oxygen Systems in Residential Buildings and Health Care Facilities. Tiré de : https://www.csagroup.org/store/search-results/?search=all~~Safe%20Storage,%20Handling,%20and%20Use%20of%20Portable%20Oxygen%20Systems%20in%20Residential%20Buildings%20and%20Health%20Care
- Cousins JL, Wark PA, McDonald VM. Acute oxygen therapy: a review of prescribing and delivery practices. Int J Chron Obstruct Pulmon Dis. 2016;11:1067-1075. Publié le 24 mai 2016, doi : 10.2147/COPD.S103607
- Gardenshire, D. (2020). Rau’s Respiratory Care Pharmacology. (10th ed.). St. Louis, MO: Mosby Inc.
- Kacmarek, R. M., Stoller, J.K. Heuer, A. J. (2013). Egan’s Fundamentals of Respiratory Care. (10th ed.). St. Louis, MO: Mosby.
- Mariciniuk, D. D., Goodridge, D., Hemandez, P., Rocker, J., Balter, M., Bailey, P., Brown, C. (2011). Managing dyspnea in patients with advanced chronic obstructive pulmonary disease: A Canadian Thoracic Society clinical practice guideline. Canadian Respiratory Journal, 18(2), 69–78. Tiré de :www.ncbi.nlm.nih.gov/pmc/articles/PMC3084418/
- Ministre de la Santé et des Soins de longue durée, Manuel des politiques et procédures du Programme d’appareils et accessoires fonctionnels (mai 2016). Conflit d’intérêts. Tiré de : Manuel des politiques et procédures du Programme d’appareils et accessoires fonctionnels (gov.on.ca)
- O'Driscoll, B. R., Howard, L. S., Earis, J., & Mak, V. (2017). British Thoracic Society Guideline for oxygen use in adults in healthcare and emergency settings. BMJ open respiratory research, 4(1), e000170. Tiré de : https://doi.org/10.1136/bmjresp-2016-000170
- Sackett, D., Rosenberg, W., Gray, J., Haynes, R., & Richardson, W. (1996). Evidence-based medicine: what it is and what it isn't. British Medical Journal, 312, 71-72. Tiré de : www.bmj.com/cgi/content/full/312/7023/71
